Zikaden leben
in nahezu allen von Pflanzen bestandenen Lebensräumen der tropischen,
gemäßigten und sogar polaren Breiten. Das Spektrum der besiedelten Bereiche
reicht vom immerfeuchten tropischen Tieflandsregenwald bis in die Halbwüste und
die arktische Tundra, von der Ebene bis ins Hochgebirge hinauf, von der
Salzwiese, dem Schwimmblattgürtel und dem Hochmoor bis hin zum Trockenrasen,
und vom Mineralboden bis in die Baumkronen. Ihre Dichten können insbesondere in
gras- und gehölzdominierten Biotopen mehrere 1000 Individuen und mehrere Gramm
Trockengewicht pro Quadratmeter betragen. Somit bilden sie eine bedeutsame
Komponente vieler Tiergemeinschaften und spielen überdies eine wichtige Rolle
als Konsumenten pflanzlicher Biomasse sowie als Nahrungsbestandteil für
räuberische Gruppen und Parasitoide. Als Überträger von Virosen und anderen
Krankheiten auf Nutzpflanzen können sie insbesondere in wärmeren Ländern auch
beträchtliche wirtschaftliche Schäden verursachen. Schließlich sind auch
indirekte Effekte auf die Konkurrenzverhältnisse zwischen Pflanzen zu vermuten,
was sich möglicherweise auf die Zusammensetzung der Vegetation auswirkt (Denno & Perfect 1994; Nault & Rodriguez 1985; Nickel & Achtziger 1999; Nickel et
al. 2002; Remane & Wachmann 1993; Waloff 1980).
Besonders bemerkenswert ist der hohe Anteil von Nährpflanzenspezialisten. Von den rund
510 Arten, die derzeit aus Bayern bekannt sind, sind jeweils rund 1/4 monophag
1. Grades, monophag 2. Grades oder oligophag 1. Grades (mit nur einer einzigen
Pflanzenart, Pflanzengattung bzw. Pflanzenfamilie assoziiert). Das verbleibende
Viertel ist oligophag 2. Grades oder polyphag, d.h. mit Pflanzenarten weniger
oder vieler Familien assoziiert (Nickel
& Remane 1996; Nickel 2002a). Zusätzlich zu dieser Nährpflanzenbindung bestehen häufig mehr oder
weniger spezielle Ansprüche an das Mikroklima, was dazu führt, dass meist nur
ein bestimmter Anteil der im Freiland angetroffenen Nährpflanzenbestände von
den jeweiligen Zikadenspezialisten besiedelt sind. Die Kenntnis der Nährpflanzen
und der mikroklimatischen Ansprüche erlaubt es, Aussagen über das potenzielle
Artenspektrum eines Gebietes zu machen, die anschließend im Freiland an Hand
von Aufsammlungen überprüft werden können. Auf diese Weise können Flächen
bewertet und miteinander verglichen werden und die Folgen von
Managementmaßnahmen vorhergesagt werden.
Im Rahmen des Projektes "Schutz und Entwicklung von Sandlebensräumen in der
Regnitzachse" wurde eine qualitative Bestandserfassung der Zikaden im
Flugsandgebiet zwischen Langensendelbach und Honings, Landkreis Forchheim,
durchgeführt. Um die Ergebnisse regional und überregional besser bewerten zu
können, wurden auch Sandstandorte in der Umgebung (zwischen Bamberg und Erlangen)
besammelt. Außerdem wurden xerotherme Jurastandorte und Feuchtlebensräume
untersucht. Ziel der Studie war es, die Zikaden-Artengemeinschaften zu
charakterisieren und im regionalen und überregionalen Kontext der fränkischen
und mitteleuropäischen Sandstandorte einzuordnen. Besonderes Augenmerk galt hierbei
den auf Sandböden spezialisierten Arten. Schließlich sollte der
Gesamtartenbestand verglichen werden mit den Ergebnissen einer faunistischen
Bestandsaufnahme der Zikaden von Trümbach (1959) aus dem Erlanger Raum, um eventuell langfristige Bestandstrends einiger Arten zu erkennen.
Während die meisten trockenheitsliebenden Zikaden eurytop auf den verschiedenartigsten
Bodensubstraten vorkommen, hat nur ein kleiner Anteil spezielle Vorlieben für
Sandböden, wobei die Sandbindung einiger Arten vermutlich eher über die
Nährpflanze besteht als direkt über die Bodenart. Hinsichtlich der Stärke der
Assoziation an sandige Substrate soll hier zwischen psammobionten und
psammophilen Arten unterschieden werden. Die Abgrenzung zwischen diesen Gruppen
wurde an Hand des Anteils der bekannten Fundorte auf Sandböden in Deutschland
vorgenommen (s. Tab. 1).
Aus dieser Datenlage lassen sich folgende Schlüsse ableiten:
- Die meisten psammobionten Arten
Mitteleuropas sind auf das küstennahe niederländisch-norddeutsch-polnische
Flachland beschränkt. Nur wenige kommen auch in den übrigen Sandregionen
vor, die meisten davon in der Oberrheinebene und dem pannonischen Raum,
nur eine einzige in Nordbayern. Da ein beträchtlicher Teil dieser Arten
entlang der west- und mitteleuropäischen Küsten endemisch sind, z.B. Chlorita pusilla und Psammotettix maritimus, muss diese
Region als ein wichtiges Evolutionszentrum angesehen werden. Die
Binnenlandstandorte sind also offenbar natürlicherweise verarmt, da sie
räumlich von der Küste isoliert sind und nur eine geringe Flächengröße
aufweisen. Dementsprechend sind die dort lebenden Populationen meist klein
und unterliegen einer hohen Aussterbewahrscheinlichkeit, verbunden mit
einer geringen Wahrscheinlichkeit der Neubesiedlung.
- Bei den psammophilen Arten ist die
Verteilung nicht ganz so ungleich. Zwar haben auch hier die meisten ihren
Verbreitungsschwerpunkt im nördlichen Flachland (einzige Ausnahme ist der
offenbar in Südosteuropa endemische Psammotettix slovacus), doch
treten fast alle auch im Mittelgebirgsraum auf (Anaceratagallia frisia
allerdings nur im Kyffhäuser). Hinzu kommt, dass gelegentlich auch
Standorte auf Lehmböden und Festgestein besiedelt werden.
- Die Gefährdungssituation sowohl der
psammobionten wie auch der psammophilen Arten ist ausgesprochen kritisch (Abb. 2). Nach den einschlägigen Roten Listen sind rund
90% dieser Sandzeigerarten derzeit in ihrem Bestand sowohl in Bayern als
auch in Deutschland gefährdet (Kategorien 0, 1, 2, 3, R). Eine Art, Handianus ignoscus, ist aktuell
sogar in ganz Deutschland nur noch aus dem Gebiet der SandAchse bekannt,
und zwar vom Tennenloher Schießplatz. Doratura
homophyla ist als einzige Art derzeit nicht gefährdet. Schon jetzt
kann man folgern, dass die Sandstandorte der nördlichen SandAchse von
landesweiter Bedeutung für den Artenschutz sind.
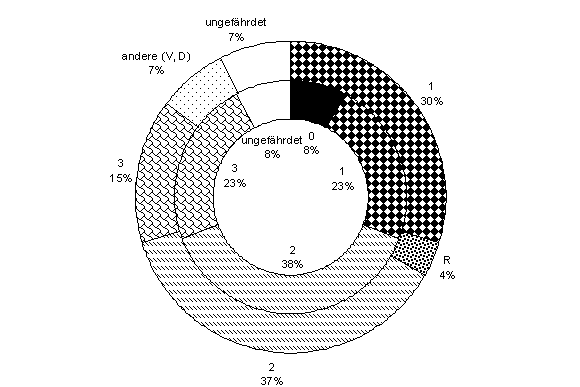
| Abb. 2:
Gefährdungssituation der psammobionten und psammophilen Zikadenarten
Deutschlands (äußerer Ring, n = 27) und Bayerns (innerer Ring, n = 13) nach den
Roten Listen (Remane et al. 1998; Nickel et al. 1999; Nickel 2002b). 0 =
ausgestorben oder verschollen, 1 = vom Aussterben bedroht, R = extrem selten, 2
= stark gefährdet, 3 = gefährdet, V = Vorwarnliste, D = Datenlage defizitär. |
Das Vorkommen der Sandspezialisten
auf den untersuchten Flächen der SandAchse ist in Tab. 3 dargestellt. Trotz nur eingeschränkt vergleichbarer
Datengrundlage werden folgende Sachverhalte ersichtlich:
- Die Flächen weisen durchaus unterschiedliche Artenbestände von
Sandspezialisten auf.
- Die Arten sind sehr ungleich und unterschiedlich verteilt.
- Mit Ausnahme der Pettstadter Sande, der Eggolsheimer Büg, der Forchheimer
Angergrube, dem Sandgebiet bei Haid und des Tennenloher Schießplatzes mit
jeweils 4 Arten weist keiner der Standorte mehr als 3 von insgesamt 12 in
Nordbayern möglichen Arten auf.
- Während Doratura homophyla und Psammotettix excisus mit jeweils 8 Fundorten noch
relativ weit verbreitet sind, wurden Muirodelphax aubei, Psammotettix
poecilus und Handianus ignoscus nur an einem einzigen Fundort
festgestellt. Die letztgenannte Art weist auf dem Schießplatz Tennenlohe
sogar ihr einziges derzeit bekanntes Vorkommen in ganz Deutschland auf.
- Die Langensendelbacher Düne ist in ihrem jetzigen Zustand nur für wenige
sandliebende Zikaden als Lebensraum geeignet. Wertvoll sind insbesondere
die ausgehagerten Waldränder (besonders in Süd- und Südwestexposition) und
die älteren Brachen, sofern sie noch offenen Sandboden aufweisen und nicht
mit Gehölzen bestanden sind. Pflegemaßnahmen könnten insbesondere im
Bereich der sonnenexponierten Waldränder (Öffnung des Gebüschmantels) und
auf einigen Lichtungen, die bereits fortschreitender Sukzession
unterworfen sind, Erfolge zeigen.
Das bedeutet also, dass einzelne Schutzgebiete nicht ausreichen, um spezielle Artengemeinschaften auf Dauer zu erhalten, zumal nicht jeder Sandstandort auch für alle Sandspezialisten geeignet ist, sondern nur für jeweils wenige Arten. Hinzu kommt, dass auch innerhalb der Schutzgebiete oftmals nur kleinflächige Bereiche besiedelt werden. Um also sensible Tierarten auf Dauer zu erhalten, muss ein Netz von möglichst großflächigen Habitaten vorhanden sein, so dass ein Überleben auch in ungünstigen Phasen der Populationsentwicklung gewährleistet ist.
Tab. 3: Fangsummen der Sandzeigerarten im Gebiet der nördlichen SandAchse. RL D = Rote Liste Deutschlands; RL B = Rote Liste Bayern; LSB = Langensendelbach; HS = Hallstadter Börstig; BAH = Bamberg, Hafen; BAF = BAmberg, Flugplatz; PS = Pettstadter Sande; EB = Eggolsheimer Büg; HD = Haid; FO = Forchheim, Angergrube; ER = Erlangen, Exerzierplatz; TL = Tennenlohe; AD = Altdorf; Ges = Fundorte gesamt. (* = Bauchhenss leg. 1991; ** = einschl. Fundort Weppersdorf)
| Art |
RLD |
RLB |
LSB |
HB |
BAH |
BAF |
PS |
EB |
HD |
FO |
ER |
TL |
AD |
Ges |
| Muirodelphax aubei (Perr.) |
D |
2 |
|
|
|
|
|
|
|
3 |
|
|
|
1 |
| Ribautodelphax collina (Boh.) |
|
3 |
1 |
|
|
|
|
|
|
|
9 |
|
|
2 |
| Neophilaenus minor (Kbm.) |
V |
3 |
|
1 |
|
|
|
1 |
|
|
|
|
4 |
3 |
| Zygina rubrovittata (Leth.) |
3 |
2 |
|
|
|
|
|
|
|
|
|
1 |
32 |
2 |
| Macrosteles quadripunctulatus (Kbm.) |
3 |
3 |
|
|
3 |
|
|
1 |
2 |
13 |
|
|
|
4 |
| Doratura homophyla (Fl.) |
|
|
1 |
7 |
1 |
|
1 |
4 |
4 |
|
1 |
21 |
|
8 |
| Hardya tenuis (Germ.) |
2 |
2 |
14 |
|
|
|
2 |
|
|
4 |
|
|
|
4** |
| Handianus ignoscus (Mel.) |
R |
1 |
|
|
|
|
|
|
|
|
|
24 |
|
1 |
| Laburrus impictifrons (Boh.) |
2 |
1 |
|
|
|
2 |
10 |
|
|
|
|
|
|
2 |
| Psammotettix poecilus (Fl.) |
2 |
2 |
|
|
|
|
|
|
59 |
|
|
|
|
2 |
| Psammotettix excisus (Mats.) |
3 |
2 |
|
7 |
|
|
5 |
16 |
32 |
2 |
1 |
15 |
22* |
8 |
Danksagung
Johannes und Christine Mohr,
Forchheim, gewährten vielfältige logistische Unterstützung. Prof. Dr. Ekkehard
Wachmann, Berlin, erlaubte die Verwendung der Fotos.
Dr. Elisabeth Bauchhenss, Schweinfurt, stellte Bodenfallenbeifänge aus dem
Sandgebiet bei Altdorf - Leinburg zur Verfügung. Ihnen allen sei hier herzlich
gedankt.
4. Literatur
Bröring, U. & Niedringhaus, R. (1989a):
Die epigäische Hemipterenfauna (Heteroptera, Auchenorrhyncha) der Tertiärdünen
Ostfriesischer Düneninseln. Braunschw. naturkdl. Schr. 3: 387-397.
Bröring, U. & Niedringhaus, R. (1989b):
Veränderungen der Wanzen- und Zikadenfauna innerhalb von 50 Jahren auf der
ostfriesischen Insel Borkum (Hemiptera: Heteroptera, Geocorisae;
Auchenorrhyncha). Oldenburger Jb. 89: 337-356.
Denno R.F. & J.T. Perfect (1994): Planthoppers: Their ecology and management. Chapman and
Hall, New York.
Emmrich, R. (1966):
Faunistisch-ökologische Untersuchungen über die Zikadenfauna (Homoptera,
Auchenorrhyncha) von Grünland-Flächen und landwirtschaftlichen Kulturen des
Greifswalder Gebietes. Mitt. Zool. Mus. Berlin 42: 61-126.
Gravestein, W.H.
(1965): New faunistic records on Homoptera - Auchenorrhyncha from Netherlands
North Sea island Terschelling. Zool. Beitr., N.F. 11: 103-111.
Györffy, G. (1980):
Auchenorrhyncha of the upper terrain of a sand soil grassland: quantitative
relations, bionomic and ecological-valence data. Acta biol. Szeged 26:
137-142.
Györffy, G. (1982):
Auchenorrhyncha of a sandy soil mosaic-grassland: Quantitative relations,
bionomic and ecological valence data. Folia entomol. Hungarica 43: 43-54.
Györffy, G. &
Abdai, E. (1996): Auchenorrhyncha assemblages of the "Ásotthalmi
Láprét" Nature Conservation Area in Hungary I. Acta biol. Szeged 41:
57-65.
Györffy, G. & Pollák, T. (1983): Habitat
specialization of leafhopper community living in a sandy soil grassland.
Folia entomol. Hungarica 43: 43-54.
Haupt, H. & Hedicke, H. (1934): Die Fauna der
Binnendüne bei Bellinchen (Oder). Märk. Tierw. 1: 41-48.
Heydemann, B., Götze, W. & Riecken, U. (1994):
Ökologische Analyse der Fauna des NSG "Barker Heide". Faun.-ökol.
Mitt., Suppl. 16: 13-47.
Kuntze, A. (1937): Die Zikaden
Mecklenburgs, eine faunistisch-ökologische Untersuchung. Arch. Naturgesch.,
N.F. 6: 299-388.
Marchand, H. (1953): Die Bedeutung der
Heuschrecken und Schnabelkerfe als Indikatoren verschiedener Graslandtypen.
Beitr. Ent. 3: 116-162.
Melber, A., Prüter, J., Assing, V., &
Sprick, P. (1996): Erste Ergebnisse der Erfassung
ausgewählter Wirbellosen-Gruppen in einer kleinen Vegetationsinsel auf den
Panzerübungsflächen des NSG Lüneburger Heide (Heteroptera; Homoptera,
Auchenorrhyncha; Coleoptera, Carabidae, Staphylinidae, Curculionidae).
NNA-Ber. 9(1): 93-102.
Nault L.R. & J.G. Rodriguez (Hrsg.) (1985): The leafhoppers and planthoppers. John Wiley & Sons,
New York.
Nickel, H. (2002a): The leafhoppers and planthoppers of Germany (Hemiptera, Auchenorrhyncha): Patterns and strategies in a highly diverse group of phytophagous insects. Dissertation Universität Göttingen. 292 pp.
Nickel, H. (2002b, eingereicht): Rote
Liste der Zikaden Bayerns (Hemiptera, Auchenorrhyncha). Schr.-R. Bayer.
Landesamt Umweltschutz.
Nickel, H., Achtziger, R. (1999):
Wiesen bewohnende Zikaden (Auchenorrhyncha) im Gradienten von
Nutzungsintensität und Feuchte. Beitr. Zikadenkde. 3: 65-80.
Nickel, H., Holzinger, W.E., Wachmann, E. (2002): Mitteleuropäische Lebensräume und ihre Zikaden (Insecta: Hemiptera:
Auchenorrhyncha). Denisia 4: 279-328.
Nickel, H. & Remane, R. (1996):
Erfassungsstand der Zikadenfauna Bayerns, mit Anmerkungen zum
Nährpflanzenspektrum und Habitat (Homoptera, Auchenorrhyncha). Verh. 14. Int.
Symp. Entomofaunistik Mitteleuropa, SIEEC, München (4.-9.9.1994): 407-420.
Nickel, H., Witsack, W. & Remane, R. (1999):
Rote Liste der Zikaden Deutschlands (Hemiptera, Auchenorrhyncha) - Habitate, Gefährdungsfaktoren
und Anmerkungen zum Areal. Beitr. Zikadenkde. 3: 13-32.
Niedringhaus, R. (1988):
Kolonisationserfolg der Zikaden auf den jungen Düneninseln Memmert und Mellum
(Hemiptera: Auchenorrhyncha). Drosera '88 (1/2): 105-122.
Niedringhaus, R. (1991):
Analyse isolierter Artengemeinschaften am Beispiel der Zikadenfauna der
ostfriesischen Düneninseln (Hemiptera: Auchenorrhyncha). Dissertation
Universität Oldenburg, 153 S.
Niedringhaus, R. (1994):
Die Zikadenfauna der Nordseeinsel Helgoland (Hemiptera: Auchenorrhyncha).
Faun.-Ökol. Mitt. 6: 469-477.
Niedringhaus, R. & Bröring, U. (1986): Wanzen und Zikaden
(Hemipteroidea - Heteroptera, Auchenorrhyncha) terrestrischer Habitate der
ostfriesischen Insel Norderney. Drosera '86 (1): 21-40.
Remane, R. (1958): Die Besiedlung von
Grünlandflächen verschiedener Herkunft durch Wanzen und Zikaden im
Weser-Ems-Gebiet. Z. ang. Ent. 42: 353-400.
Remane, R. (1987): Zum Artenbestand der
Zikaden (Homoptera: Auchenorrhyncha) auf dem Mainzer Sand. Mainzer naturw.
Arch. 25: 273-349.
Remane, R., Achtziger, R., Fröhlich, W.
Nickel, H. & Witsack, W. (1998): Rote Liste der Zikaden (Homoptera,
Auchenorrhyncha). In: Binot, M., Bless,
R., Boye, P., Gruttke, H. & Pretscher, P. (Hrsg.): Rote Liste
gefährdeter Tiere Deutschlands. Schr.-R. Landschaftspflege u. Naturschutz 55:
243-249.
Remane, R. & Wachmann, E. (1993):
Zikaden: kennenlernen - beobachten. Naturbuch Verlag, Augsburg.
Schaefer, M. (1973): Untersuchungen über
Habitatbindung und ökologische Isolation der Zikaden einer Küstenlandschaft
(Homoptera: Auchenorrhyncha). Arch. Natursch. Landschaftsforsch. 13: 329-352.
Schiemenz, H. (1968): Zur Zikaden- und
Heuschreckenfauna der Naturschutzgebiete "Groß Machnower Weinberg",
"Große und Kleine Jahnberge", "Geesower Hügel",
"Oderberge", "Priesterschlucht", "Wollberg und
Oderbruchrand". Brandenburg. Naturschutzgebiete, Folge 5-10.
Schiemenz, H. (1969): Die Zikadenfauna
mitteleuropäischer Trockenrasen (Homoptera, Auchenorrhyncha). Untersuchungen zu
ihrer Phänologie, Ökologie, Bionomie und Chorologie. Ent. Abh. staatl. Mus.
Tierk. Dresden 36: 201-280.
Trümbach, H. (1959): Die Zikaden und
Psylliden der Umgebung Erlangens, eine systematisch-ökologische Untersuchung.
Sitz.-ber. phys.-med. Soz. Erlangen 79: 102-151.
Wagner, W. (1939): Die Zikaden des
Mainzer Beckens. Jb. nass. Ver. Naturk. 86: 77-212.
Waloff, N. (1980):
Studies on grassland leafhoppers and their natural enemies. Adv. Ecol. Res.
11: 81-215.
Wonn, L. (1956): Ökologische Studien
über die Zikadenfauna der Mainzer Sande. Jb. Nassau. Ver. Naturk. 92: 81-122.