Die Dermaptera sind eine vergleichsweise artenarme
Insektengruppe. Die meisten der etwa 2.000 Arten kommen in
tropischen und subtropischen Gebieten vor, in Deutschland ist
die Gruppe nur mit einer Handvoll Arten vertreten. Die meisten
Arten sind klein (3-5 mm) bis mittelgroß (ca. 1-1,5 cm). Die
größte Art ist mit einer Körperlänge von fast 9 cm der
Herkulesohrwurm Labidura herculeana. Diese flugunfähige Art
ist auf der Insel St. Helena im Südatlantik endemisch, gilt
jedoch inzwischen als ausgerottet, da es seit Jahrzehnten
keine Lebendsichtungen der Art mehr gab.
Die Dermaptera sind dämmerungs- und nachtaktiv und halten sich
tagsüber gern in engen, dunklen Schlupfwinkeln auf (z. B.
unter Baumrinde, liegendem Totholz und Steinen oder in
Bodenspalten, Falllaub, Sand). Wie ihr Name suggeriert, können
sie dabei tatsächlich auch Körperöffnungen von Tieren (z. B.
den äußeren Gehörgang des Ohrs) aufsuchen. Die Volkserzählung,
dass die Ohrwürmer nachts in das Ohr schlafender Menschen
krabbeln und von dort bis in das Gehirn vordringen, ist jedoch
nicht wahr. Die Schlafenszeit der meisten Menschen (=nachts)
fällt mit der Aktivitätsphase der Dermaptera zusammen, in der
die Tiere also keine Schlupfwinkel aufsuchen. Falls es
trotzdem einmal vorkommt, dass ein Tier den Gehörgang eines
Menschen als Schlupfwinkel aufgesucht hat, verletzen die Tiere
das Ohr nicht. Bei dem Versuch die Tiere zu entfernen, kann es
jedoch zu oberflächlichen Reizungen des Gehörgangs und des
Trommelfells kommen, hervorgerufen durch die
Verteidigungsflüssigkeit der Tiere (siehe z. B. Fisher 1986;
Jeong et al. 2021).
Die Färbung der Dermaptera ist überwiegend schwarz oder braun,
nur wenige Arten haben zusätzliche Zeichnungselemente wie z.
B. hellere Punkte oder Streifen. Der Körper der Tiere ist
langgestreckt und abgeflacht. Der Kopf trägt kauend-beißende,
nach vorn gestreckte (prognathe) Mundgliedmaßen und
vielgliedrige (6 bis 15 Antennomere) fadenförmige Antennen.
Die Kauladen des Labiums (Glossae und Paraglossae) sind
miteinander verschmolzen und bilden dadurch eine einheitliche
Unterlippe. Die Komplexaugen sind bei den meisten Arten gut
entwickelt, sind bei manchen parasitischen Arten aber stark
reduziert. Scheitelaugen (Ocellen) fehlen bei den rezenten
Arten immer.
Die drei Thoraxsegmente sind gegeneinander frei beweglich. Die
Tarsengliederung ist reduziert, es sind an allen Laufbeinen
nur 3 Tarsenglieder vorhanden, die bei vielen Arten
verschiedenartige Haftstrukturen besitzen (Haas & Gorb
2004). Die Flügel sind bei vielen Arten zurückgebildet oder
fehlen völlig; wenn Vorderflügel vorhanden sind, sind sie
stets verkürzt und stark sklerotisiert. Sie bilden die
Deckflügel (Elytren) für die überwiegend häutigen
Hinterflügel, sofern diese vorhanden sind. Wenn gut
ausgebildete Hinterflügel vorhanden sind, sind die Tiere meist
auch flugfähig. Die Hinterflügel werden dann in der Ruhe in
einem komplexen Faltvorgang zusammengefaltet und unter die
Elytren verpackt. Die Faltung der Hinterflügel wird durch
spezielle Gelenkfalten in der Flügelfläche ermöglicht. So
können die Hinterflügel wie ein Fächer zusammengelegt und an
den Gelenkfalten nochmals nach oben und unten abgeknickt
werden. Die Hinterflügelfläche reduziert sich dabei auf etwa
10% der Fläche des ausgefalteten Flügels. Trotzdem stehen bei
vielen Arten die Hinterflügel teilweise unter den Elytren
hervor. Das Zusammenfalten geschieht von selbst, da die
Hinterflügel von Resilineinlagerungen durchzogen sind, die in
den Hinterflügeln eine interne Spannung erzeugen, die wie
Gummibänder entlang der Flügelfläche nach innen (d. h. zum
Zusammenfalten) ziehen (Haas et al. 2000). Das bedeutet
gleichzeitig, dass die Entfaltung der Flügel ein aktiver
Prozess ist, der gegen die Resilinspannung anarbeiten muss.
Zusätzlich können die Gelenkfalten nach erfolgter Faltung
eingerastet werden, so dass ein unbeabsichtigtes
Wiedereinfalten wegen des andauernden Zugs der Resilinspannung
vermieden wird. Flugfähige Arten benutzen für dieses Auspacken
und Ausfalten der Hinterflügel die beweglichen Cerci am Ende
ihres Hinterleibs.
Das Abdomen der meisten Arten trägt an seinem Ende ein Paar
langer, stark sklerotisierter Cerci, die vor allem bei den
Männchen zangenartig gebogen und mit Zähnchen und Dornen
versehen sind ("Kneifzangen"). Die Cerci erfüllen vielfältige
Aufgaben. Bei flugfähigen Arten nutzen beide Geschlechter die
Cerci, um das Hinterflügelpaket vor dem Start zu entfalten;
das Zusammenfalten nach der Landung gelingt jedoch bei den
meisten Arten ohne Hilfe der Cerci. Mit den Cerci werden auch
andere Insekten (einschließlich Artgenossen) ergriffen und
abgewehrt, die Körperoberfläche gereinigt, und auch bei der
Paarung werden die Cerci bei manchen Arten eingesetzt, damit
die Männchen das Abdomen der Weibchen ergreifen und in
Kopulationsstellung bringen können. Die Männchen bilden am
Abdomen noch einen 10. Tergiten aus, während die Weibchen nur
8 oder 9 Tergite ausbilden. Tergite bzw. Sternite der
Abdominalsegmente überlappen die Tergite bzw. Sternite des
jeweils nachfolgenden Segments, weshalb sie gut übereinander
geschoben werden können und so dem Abdomen der Dermaptera eine
außerordentliche Beweglichkeit verleihen. Am 9.
Abdominalsegment sitzt bei beiden Geschlechtern die
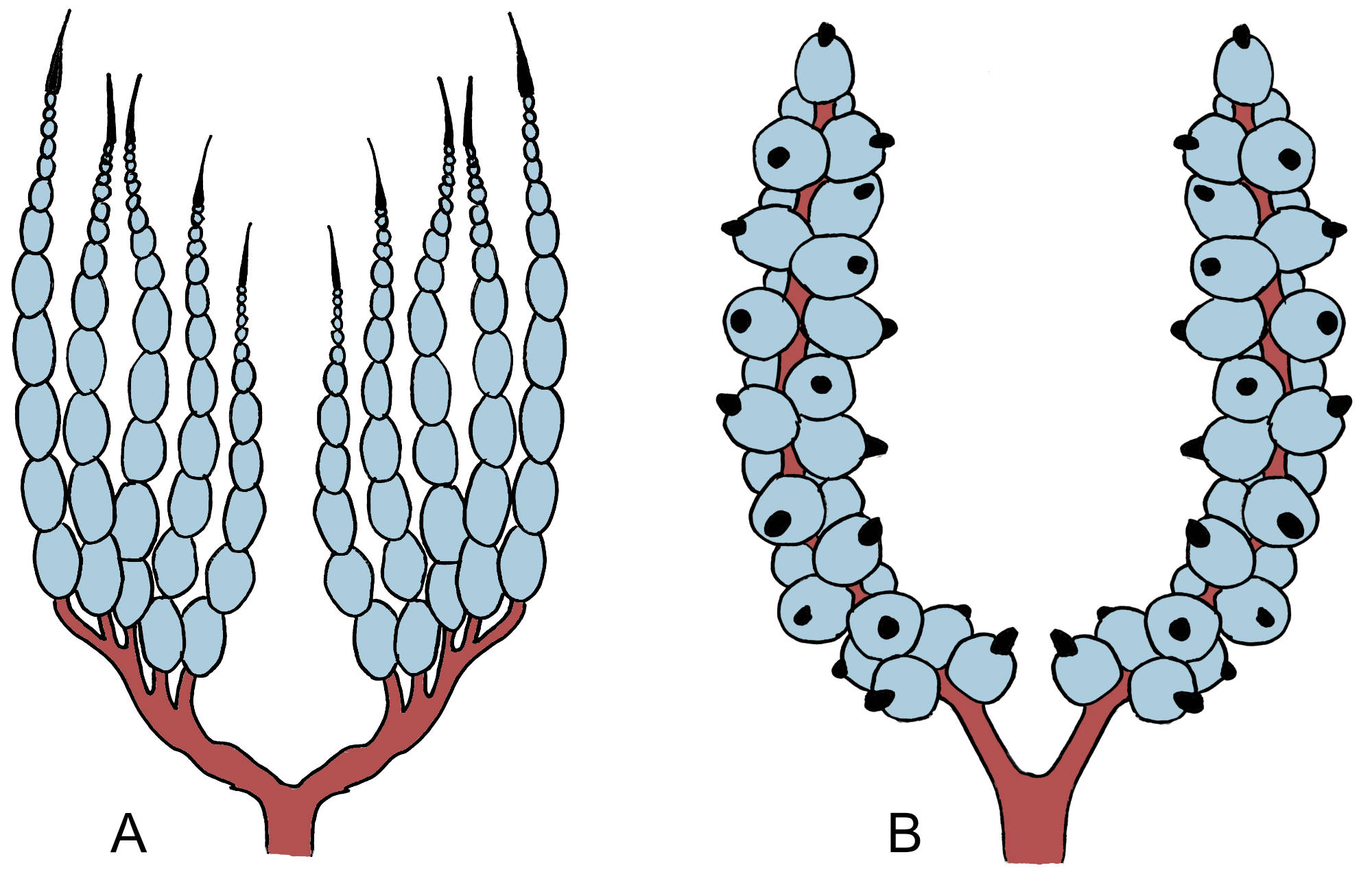
Geschlechtsöffung. Die inneren Geschlechtsorgane der Weibchen
(Ovarien) bestehen aus einzelnen Ovariolen vom
meroistisch-polytrophen Typus (Abb. 1), jede Eikammer
(Follikel) ist also in ein Eifach und ein Nährfach unterteilt
(Tworzydlo & Bilinski 2008; Tworzydlo et al. 2010). Die
Weibchen besitzen einen dünnen Ovipositor zur Eiablage, bei
den Männchen mancher Arten gibt es ein penisartiges
Begattungsorgan. Am 3. und 4. Abdominalsegment besitzen die
meisten Arten je ein Drüsenpaar, aus denen eine
Abwehrflüssigkeit abgesondert werden kann. Die
Abwehrflüssigkeit enthält unter anderem Benzochinon und kann
von vielen Arten gezielt versprüht werden.
Das Nervensystem zeigt im Bereich des Bauchmarks sekundäre
Konzentrationen durch Zusammenfassung von Einzelganglien zu
Synganglien; es sind im Abdomen nur insgesamt 6 (Syn-)Ganglien
vorhanden und das Ganglion des ersten Absominalsegments ist
mit dem Ganglion des dritten Thorakalsegments zu einem
einheitlichen Synganglion verschmolzen. Im Verdauungs- und
Exkretionssystem fallen der große Kropf im vorderen Abschnitt
des Verdauungstraktes, der stark entwickelte Fettkörper mit
Speicherfunktion für Harnsäure und die zahlreichen (5-15),
fadenförmigen Malpighischen Gefäße auf. Das Atmungssystem
besteht aus gut ausgebildeten Tracheen, es fehlen jedoch
Aussackungen und Luftsäcke.
Die Dermaptera sind größtenteils Allesfresser, die Larven und
die Imagines ernähren sich überwiegend gleich; den Hauptteil
(ca. 70%) der Nahrung bilden pflanzliche Materialien und
Pilze, zu etwa 30% wird jedoch auch tierisches Material
aufgenommen, meist als totes Material (Saprophagie), manche
Arten ernähren sich aber auch räuberisch.
Der Paarung geht oft ein Balzverhalten voraus, die Männchen
mancher Arten vollführen einen kurzen Balztanz. Die Weibchen
paaren sich üblicherweise mit mehreren Männchen und speichern
das Sperma in Receptacula seminis (auch als Spermathecae
bezeichnet). Wenige Arten sind lebendgebärend (vivipar), die
allermeisten Arten legen Eier, meist in Gelegen zu bis zu 50
oder mehr Eiern. Bei vielen Arten kommt umfangreiche
Brutpflege durch das Weibchen vor; es werden sowohl Nester für
das Gelege gebaut, als auch die Gelege bewacht, gesäubert und
umgeschichtet. Ohne diese Fürsorge durch die Mutter verpilzen
die Gelege schnell und sterben ab. Manche Arten sammeln
Nahrungsvorräte für die Nachkommen beim Gelege oder umsorgen
die Nachkommen auch noch nach dem Schlüpfen. Die ersten
Larvenstadien sind wenig pigmentiert und noch vergleichsweise
unreif (z. B. geringe Zahl von Fühlergliedern, noch fädige,
segmentierte und weiche Cerci, Flügelanlagen erscheinen sehr
spät). Nach 4 oder 5 (in wenigen Gattungen auch 6 oder mehr;
Shimizu & Machida 2024) Larvenstadien (Nymphen) ist die
Imago erreicht (hemimetabole Entwicklung).
Die Systematik der Dermaptera ist ein interessantes
zoologisches Problem, denn trotz einiger sehr sorgfältiger
Studien sind die Verwandtschaftsbeziehungen innerhalb der
Dermaptera völlig ungeklärt. Weder das Studium morphologischer
Merkmale (Jarvis et al. 2005), oder von fossilen Formen (Zhao
et al. 2010), noch die phylogenetische Analyse von
DNA-Sequenzen (Kocarek et al. 2013; Naegele et al. 2016;
Wipfler et al. 2020) konnten bisher ein einheitliches Bild
liefern. Traditionell wird der Großteil der Dermaptera in eine
Gruppe Forficulina eingeteilt, der zwei stark abgeleitete
epizoisch lebende Gruppen Arixenina und Hemimerina
gegenübergestellt werden. Die Arixenina kommen mit 5 Arten in
Südostasien vor und leben in der Gesellschaft von
Fledermäusen. Sie haben reduzierte Augen, sind flügellos und
die kurzen Cerci können nicht zangenartig geschlossen werden.
Die Hemimerina kommen mit 11 Arten im tropischen Afrika vor
und leben im Fell von Hamsterratten. Sie sind völlig blind und
flügellos und haben unbewegliche, fadenförmige Cerci. Beide
Gruppen sind ganz offensichtlich durch ihre epizoische und
möglicherweise ektoparasitische Lebensweise stark abgeleitet,
und es ist inzwischen klar, dass sie keine basalen Gruppen im
Stammbaum der Dermaptera darstellen, sondern weiter oben im
Stammbaum aus "höheren" Dermaptera hervorgegangen sind. Die
bisher verfügbaren Analysen widersprechen sich jedoch in so
vielfacher Weise, so dass man noch keinen Konsensus
feststellen kann, und ich hier deshalb auch die Gruppierungen,
die in diesen Stammbäumen abgegrenzt werden (z. B.
Epidermaptera, Eudermaptera, Protodermaptera), nicht verwende.
Beachtenswert ist aber vor allem, dass in diesen Analysen
mehrere Familien nicht als monophyletische Gruppen erscheinen.
Sollten sich diese Befunde erhärten, dann wären grundlegende
systematische Änderungen auf dem Niveau der Familien und
vermutlich auch mancher Gattungen notwendig.
Haas F, Gorb S, Wootton RJ. 2002. Elastic joints in dermapteran hind wings: materials and wing folding. Arthropod Structure & Development 29, 137-146.
Haas F, Gorb S. 2004. Evolution of locomotory attachment pads in the Dermaptera (Insecta). Arthropod Structure & Development 33, 45-66.
Jarvis KJ, Haas F, Whiting MF. 2005. Phylogeny of earwigs (Insecta: Dermaptera) based on molecular and morphological evidence: reconsidering the classification of Dermaptera. Systematic Entomology 30, 442-453.
Jeong H, Shin JE, Kim CH. 2021. Earwig Crawling in the Ear: Myth or Truth. Cureus 13, e14827.
Kocarek P, John V, Hulva P. 2013. When the body hides the ancestry: phylogeny of mophologically modified epizoic earwigs based on molecular evidence. PLoS ONE 6, e66900.
Naegele MA, Mugleston JD, Bybee SM, Whiting MF. 2016. Reassessing the phylogenetic position of the epizoic earwigs (Insecta: Dermaptera). Molecular Phylogenetics and Evolution 100, 382-390.
Shimizu S, Machida R. 2024. Development and reproductive biology of Dermaptera: a comparative study of thirteen species from eight families. Arthropod Systematics & Phylogeny 82, 35-75.
Tworzydlo W, Bilinski SM. 2008. Structure of ovaries and oogenesis in dermapterans. I. Origin and functioning of the ovarian follicles. Arthropod Structure & Development 37, 310-320.
Tworzydlo W, Bilinski SM, Kocarek P, Haas F. 2010. Ovaries and germline cysts and their evolution in Dermaptera (Insecta). Arthropod Structure & Development 39, 360-368.
Wipfler B, Koehler W, Frandsen PB, Donath A, Liu S, Machida R, Misof B, Peters RS, Shimizu S, Zhou X, Simon S. 2020. Phylogenomics changes our understanding about earwig evolution. Systematic Entomology 45, 516-526.
Zhao J, Zhao Y, Shih C, Ren D, Wang Y. 2010. Transitional fossil earwigs - a missing link in Dermaptera evolution. BMC Evolutionary Biology 10, 344.